亞盛醫藥-B(06855)獲FDA許可,允許開展lisaftoclax(APG-2575)針對過往接受過治療的CLL/SLL患者的注冊3期試驗
 (相關資料圖)
(相關資料圖)
智通財經APP訊,亞盛醫藥-B(06855)發布公告,該公司已獲美國食品及藥物管理局(FDA)的許可,允許開展lisaftoclax (APG-2575)針對過往接受過治療的慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/SLL)患者的注冊3期試驗。此乃繼2021 年12月中國藥品審評中心(CDE)批準lisaftoclax針對復發/難治性CLL/SLL(R/ R CLL/SLL)患者的關鍵注冊2期臨床試驗后的又一重要里程碑。根據最新成果, lisaftoclax針對接受lisaftoclax與acalabrutinib聯合治療的R/R CLL/SLL患者的客觀反應率(ORR)達到98%。
此試驗(臨床試驗方案APG2575CG301)命名為GLORA,是一項全球、多中心、隨機對照、注冊3期臨床試驗,旨在評估對既往經過治療的患者,lisaftoclax (APG-2575)與BTKi(布魯頓氏酪氨酸激酶抑制劑)聯合治療的療效及安全性。該研究將于2023年下半年開始。
Lisaftoclax (APG-2575)是亞盛醫藥在研的新型口服Bcl-2選擇性小分子抑制劑,通過選擇性抑制Bcl-2,恢復各種惡性腫瘤的凋亡,從而達到治療腫瘤的目的。目前已有超過600名患者接受lisaftoclax (APG-2575)的治療,其中包括300多名 CLL/SLL患者。截至本公告日期已進行臨床試驗的初步結果表明,lisaftoclax (APG-2575)對該等患者而言是一種安全高效的治療方案。通常情況下,lisaftoclax (APG-2575)的起始每日劑量爬坡,可于一周內達到治療劑量,而市面上或開發中的其他Bcl-2抑制劑可能需要一個月或以上時間完成起始爬坡。這種特點可能進而允許lisaftoclax (APG-2575)提供卓越的便利性,更早達到全效劑量,因此減少整體醫療開支。lisaftoclax (APG-2575)此前已在美國獲得關于CLL以及急性髓系白血病(AML)、濾泡性淋巴瘤(FL)及多發性骨髓瘤(MM)等其他適應癥的孤兒藥資格認定(ODD)。
CLL/SLL是成人中最常見的白血病類型,占西方白血病病例的四分之一,全球每年新增超過10萬例。全球范圍內治療CLL/SLL的龐大醫療需求尚未得到滿足。盡管目前一線治療有很多初始療法,例如免疫療法、化學療法及BTK抑制劑,但復發和抗藥性仍是主要的臨床挑戰。這種疾病仍屬無法治癒,而帶有惡性預后指標的患者通常面臨早期復發、有效時間短及/或無治療期。lisaftoclax (APG-2575)單藥治療及聯合BTKi治療均顯示出出色的持久療效及安全性。
關鍵詞:
-
 亞盛醫藥-B(06855)獲FDA許可,允許開展lisaftoclax(APG-2575)針對過往接受過治療的... 智通財經APP訊,亞盛醫藥-B(06855)發布公告,該公司已獲美國食品及藥物
亞盛醫藥-B(06855)獲FDA許可,允許開展lisaftoclax(APG-2575)針對過往接受過治療的... 智通財經APP訊,亞盛醫藥-B(06855)發布公告,該公司已獲美國食品及藥物 -
 中泰證券:給予吉林敖東買入評級 中泰證券股份有限公司蔣嶠,祝嘉琦,孫宇瑤近期對吉林敖東(000623)進行研
中泰證券:給予吉林敖東買入評級 中泰證券股份有限公司蔣嶠,祝嘉琦,孫宇瑤近期對吉林敖東(000623)進行研 -
 華潤醫藥(03320):東阿阿膠(000423.SZ)上半年凈利潤5.31億元 同比增長72.29% 智通財經APP訊,華潤醫藥(03320)發布公告,該集團附屬公司東阿阿膠(000
華潤醫藥(03320):東阿阿膠(000423.SZ)上半年凈利潤5.31億元 同比增長72.29% 智通財經APP訊,華潤醫藥(03320)發布公告,該集團附屬公司東阿阿膠(000 -
 普門科技(688389.SH):公司的CO2脈沖激光治療機(超光刀)已于去年獲得注冊證 格隆匯8月7日丨普門科技(688389 SH)近期在接待機構投資者調研時表示,
普門科技(688389.SH):公司的CO2脈沖激光治療機(超光刀)已于去年獲得注冊證 格隆匯8月7日丨普門科技(688389 SH)近期在接待機構投資者調研時表示, -
 銘利達(301268.SZ)回撥后網上定價發行中簽率為0.023% 智通財經APP訊,銘利達(301268 SZ)發布公告,回撥后,網下最終發行數量
銘利達(301268.SZ)回撥后網上定價發行中簽率為0.023% 智通財經APP訊,銘利達(301268 SZ)發布公告,回撥后,網下最終發行數量 -
 峨眉山A:根據有關規定,公司在定期報告中披露相關股東總數信息 峨眉山A(000888)07月31日在投資者關系平臺上答復了投資者關心的問題。
峨眉山A:根據有關規定,公司在定期報告中披露相關股東總數信息 峨眉山A(000888)07月31日在投資者關系平臺上答復了投資者關心的問題。
-
 亞盛醫藥-B(06855)獲FDA許可,允許開展lisaftoclax(APG-2575)針對過往接受過治療的... 智通財經APP訊,亞盛醫藥-B(06855)發布公告,該公司已獲美國食品及藥物
亞盛醫藥-B(06855)獲FDA許可,允許開展lisaftoclax(APG-2575)針對過往接受過治療的... 智通財經APP訊,亞盛醫藥-B(06855)發布公告,該公司已獲美國食品及藥物 -
 中泰證券:給予吉林敖東買入評級 中泰證券股份有限公司蔣嶠,祝嘉琦,孫宇瑤近期對吉林敖東(000623)進行研
中泰證券:給予吉林敖東買入評級 中泰證券股份有限公司蔣嶠,祝嘉琦,孫宇瑤近期對吉林敖東(000623)進行研 -
 華潤醫藥(03320):東阿阿膠(000423.SZ)上半年凈利潤5.31億元 同比增長72.29% 智通財經APP訊,華潤醫藥(03320)發布公告,該集團附屬公司東阿阿膠(000
華潤醫藥(03320):東阿阿膠(000423.SZ)上半年凈利潤5.31億元 同比增長72.29% 智通財經APP訊,華潤醫藥(03320)發布公告,該集團附屬公司東阿阿膠(000 -
 普門科技(688389.SH):公司的CO2脈沖激光治療機(超光刀)已于去年獲得注冊證 格隆匯8月7日丨普門科技(688389 SH)近期在接待機構投資者調研時表示,
普門科技(688389.SH):公司的CO2脈沖激光治療機(超光刀)已于去年獲得注冊證 格隆匯8月7日丨普門科技(688389 SH)近期在接待機構投資者調研時表示, -
 DS自然探索賽登陸包頭 走進自然,挑戰自我。8月5日至6日,DS自然探索賽在九原區阿嘎如泰嘎查
DS自然探索賽登陸包頭 走進自然,挑戰自我。8月5日至6日,DS自然探索賽在九原區阿嘎如泰嘎查 -
 存款突然不見了…大量儲戶緊急反映,銀行回應 存款突然不見了…大量儲戶緊急反映,銀行回應
存款突然不見了…大量儲戶緊急反映,銀行回應 存款突然不見了…大量儲戶緊急反映,銀行回應 -
 中國男籃居然這么菜?被意大利18分虐殺,李凱爾再強也無用 中國男籃居然這么菜?被意大利18分虐殺,李凱爾再強也無用,周琦,方碩,
中國男籃居然這么菜?被意大利18分虐殺,李凱爾再強也無用 中國男籃居然這么菜?被意大利18分虐殺,李凱爾再強也無用,周琦,方碩, -
 銘利達(301268.SZ)回撥后網上定價發行中簽率為0.023% 智通財經APP訊,銘利達(301268 SZ)發布公告,回撥后,網下最終發行數量
銘利達(301268.SZ)回撥后網上定價發行中簽率為0.023% 智通財經APP訊,銘利達(301268 SZ)發布公告,回撥后,網下最終發行數量 -
 文化視點 | 周末連續兩天單日票房超5億元!現實關切成為中國電影市場真“流量” 《孤注一擲》海報。剛過去的周末,中國電影市場再度刷新屬于夏天的“高
文化視點 | 周末連續兩天單日票房超5億元!現實關切成為中國電影市場真“流量” 《孤注一擲》海報。剛過去的周末,中國電影市場再度刷新屬于夏天的“高 -
 全方位確保寄遞信息安全 簽收快遞如今已是很多人的日常。近日,不少網友反映,自己收到了來源不
全方位確保寄遞信息安全 簽收快遞如今已是很多人的日常。近日,不少網友反映,自己收到了來源不 -
 峨眉山A:根據有關規定,公司在定期報告中披露相關股東總數信息 峨眉山A(000888)07月31日在投資者關系平臺上答復了投資者關心的問題。
峨眉山A:根據有關規定,公司在定期報告中披露相關股東總數信息 峨眉山A(000888)07月31日在投資者關系平臺上答復了投資者關心的問題。 -
 柔道帶什么東西(柔道帶什么武器) 很多人對柔道帶什么東西,柔道帶什么武器不是很了解那具體是什么情況呢
柔道帶什么東西(柔道帶什么武器) 很多人對柔道帶什么東西,柔道帶什么武器不是很了解那具體是什么情況呢 -
 上半年合作區經濟企穩回升態勢明顯 橫琴融合發展活力足 橫琴粵澳深度合作區(以下簡稱“合作區”)上半年經濟成績單出爐。根據
上半年合作區經濟企穩回升態勢明顯 橫琴融合發展活力足 橫琴粵澳深度合作區(以下簡稱“合作區”)上半年經濟成績單出爐。根據 -
 繁體字體下載大全免費(繁體字庫免費下載) 今日翻閱書籍,被一本民國時期小學教材驚艷。白駒過隙,匆匆百年,我們
繁體字體下載大全免費(繁體字庫免費下載) 今日翻閱書籍,被一本民國時期小學教材驚艷。白駒過隙,匆匆百年,我們 -
 大眾ID.3電池電動兩廂車可以說是數十年來汽車制造商最重要的新車型 大眾ID 3電池電動兩廂車可以說是數十年來汽車制造商最重要的新車型。但
大眾ID.3電池電動兩廂車可以說是數十年來汽車制造商最重要的新車型 大眾ID 3電池電動兩廂車可以說是數十年來汽車制造商最重要的新車型。但 -
 哈爾濱平房區(哈經開區)激發生物科技源動力 構筑經開發展新優勢 一場推動生物經濟“換道超車”的高端對話,猶如一場勁風,為龍江生物領
哈爾濱平房區(哈經開區)激發生物科技源動力 構筑經開發展新優勢 一場推動生物經濟“換道超車”的高端對話,猶如一場勁風,為龍江生物領 -
 筆記本電腦截圖都保存在哪里了(筆記本電腦截圖) 記本電腦截圖都保存在哪里了,筆記本電腦截圖這個問題很多朋友還不知道
筆記本電腦截圖都保存在哪里了(筆記本電腦截圖) 記本電腦截圖都保存在哪里了,筆記本電腦截圖這個問題很多朋友還不知道 -
 暑期愛心志愿服務,醫務人員子女們為同齡患者送關愛 暑期愛心志愿服務,醫務人員子女們為同齡患者送關愛---8月4日,武漢大
暑期愛心志愿服務,醫務人員子女們為同齡患者送關愛 暑期愛心志愿服務,醫務人員子女們為同齡患者送關愛---8月4日,武漢大 -
 各級市場監管部門加強執法檢查 維護汛期市場價格秩序穩定 央視網消息:市場監管總局8月5日發布關于汛期維護市場價格秩序穩定的公
各級市場監管部門加強執法檢查 維護汛期市場價格秩序穩定 央視網消息:市場監管總局8月5日發布關于汛期維護市場價格秩序穩定的公 -
 不能沒有你!麥迪遜造點,凱恩點射破門,全場球迷獻上掌聲 直播吧08月06日訊熱刺對陣頓涅茨克礦工的友誼賽正在進行。比賽第37分鐘
不能沒有你!麥迪遜造點,凱恩點射破門,全場球迷獻上掌聲 直播吧08月06日訊熱刺對陣頓涅茨克礦工的友誼賽正在進行。比賽第37分鐘 -
 下半年:VC就投這些賽道 今年一定是個融資好年,錯過1年等3年。跟著鉛筆道,去學習今年的100個
下半年:VC就投這些賽道 今年一定是個融資好年,錯過1年等3年。跟著鉛筆道,去學習今年的100個 -
 越漲越賣,逾65億資金出逃證券ETF!這些ETF獲資金加倉 數據是個寶數據寶炒股少煩惱近期,券商股、證券ETF迎來大爆發。本周A股
越漲越賣,逾65億資金出逃證券ETF!這些ETF獲資金加倉 數據是個寶數據寶炒股少煩惱近期,券商股、證券ETF迎來大爆發。本周A股 -
 藏格礦業:公司中試生產產品為鎂基超分子層狀結構功能材料,不是鎂基超導新材料,... 藏格礦業(000408)08月06日在投資者關系平臺上答復了投資者關心的問題。
藏格礦業:公司中試生產產品為鎂基超分子層狀結構功能材料,不是鎂基超導新材料,... 藏格礦業(000408)08月06日在投資者關系平臺上答復了投資者關心的問題。 -
 維科精密:公司銷售給意力速電子的CATL BMS電池包連接器可應用到小鵬G6車型 維科精密(301499)08月06日在投資者關系平臺上答復了投資者關心的問題。
維科精密:公司銷售給意力速電子的CATL BMS電池包連接器可應用到小鵬G6車型 維科精密(301499)08月06日在投資者關系平臺上答復了投資者關心的問題。 -
 中泰證券:中長期機器人等多個消費場景有望爆發 稀土板塊長期趨勢未改 中泰證券研報認為,中長線繼續推薦稀土永磁、銻板塊。1)稀土:需求端
中泰證券:中長期機器人等多個消費場景有望爆發 稀土板塊長期趨勢未改 中泰證券研報認為,中長線繼續推薦稀土永磁、銻板塊。1)稀土:需求端 -
 萬源龍潭河旅游度假區入圍“省級旅游度假區” 萬源龍潭河旅游度假區入圍“省級旅游度假區”
萬源龍潭河旅游度假區入圍“省級旅游度假區” 萬源龍潭河旅游度假區入圍“省級旅游度假區” -
 漢景帝“廢長立幼”,狠心逼兒子和名將自裁,背后竟藏有大智慧! 漢景帝“廢長立幼”,狠心逼兒子和名將自裁,背后竟藏有大智慧!,原創
漢景帝“廢長立幼”,狠心逼兒子和名將自裁,背后竟藏有大智慧! 漢景帝“廢長立幼”,狠心逼兒子和名將自裁,背后竟藏有大智慧!,原創 -
 東風科技再發配股提示:最后2天!錯過繳款將有除權損失 東風科技(600081 SH)配股于8月2日正式啟動。8月4日,東風科技(600081)
東風科技再發配股提示:最后2天!錯過繳款將有除權損失 東風科技(600081 SH)配股于8月2日正式啟動。8月4日,東風科技(600081) -
 兩大化工新品種即將上線,更多特色品種在路上 對二甲苯和燒堿期貨、期權合約即將掛牌上線!8月4日,鄭商所分別就對二
兩大化工新品種即將上線,更多特色品種在路上 對二甲苯和燒堿期貨、期權合約即將掛牌上線!8月4日,鄭商所分別就對二 -
 安徽省當涂縣發布雷雨大風黃色預警 當涂縣氣象臺2023年08月06日15時56分發布雷雨大風黃色預警信號。目前我
安徽省當涂縣發布雷雨大風黃色預警 當涂縣氣象臺2023年08月06日15時56分發布雷雨大風黃色預警信號。目前我
熱門資訊
-
 動力無憂、里程無慮、省錢低碳,亞太精睿傳動成功研發重型礦車混動系統 近期,蘇州亞太精睿傳動成功研發出...
動力無憂、里程無慮、省錢低碳,亞太精睿傳動成功研發重型礦車混動系統 近期,蘇州亞太精睿傳動成功研發出... -
 行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監管、公安、市...
行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監管、公安、市... -
 58汽車聯合J.D. Power發布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現 保值率是汽車品牌溢價與產品力的重...
58汽車聯合J.D. Power發布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現 保值率是汽車品牌溢價與產品力的重... -
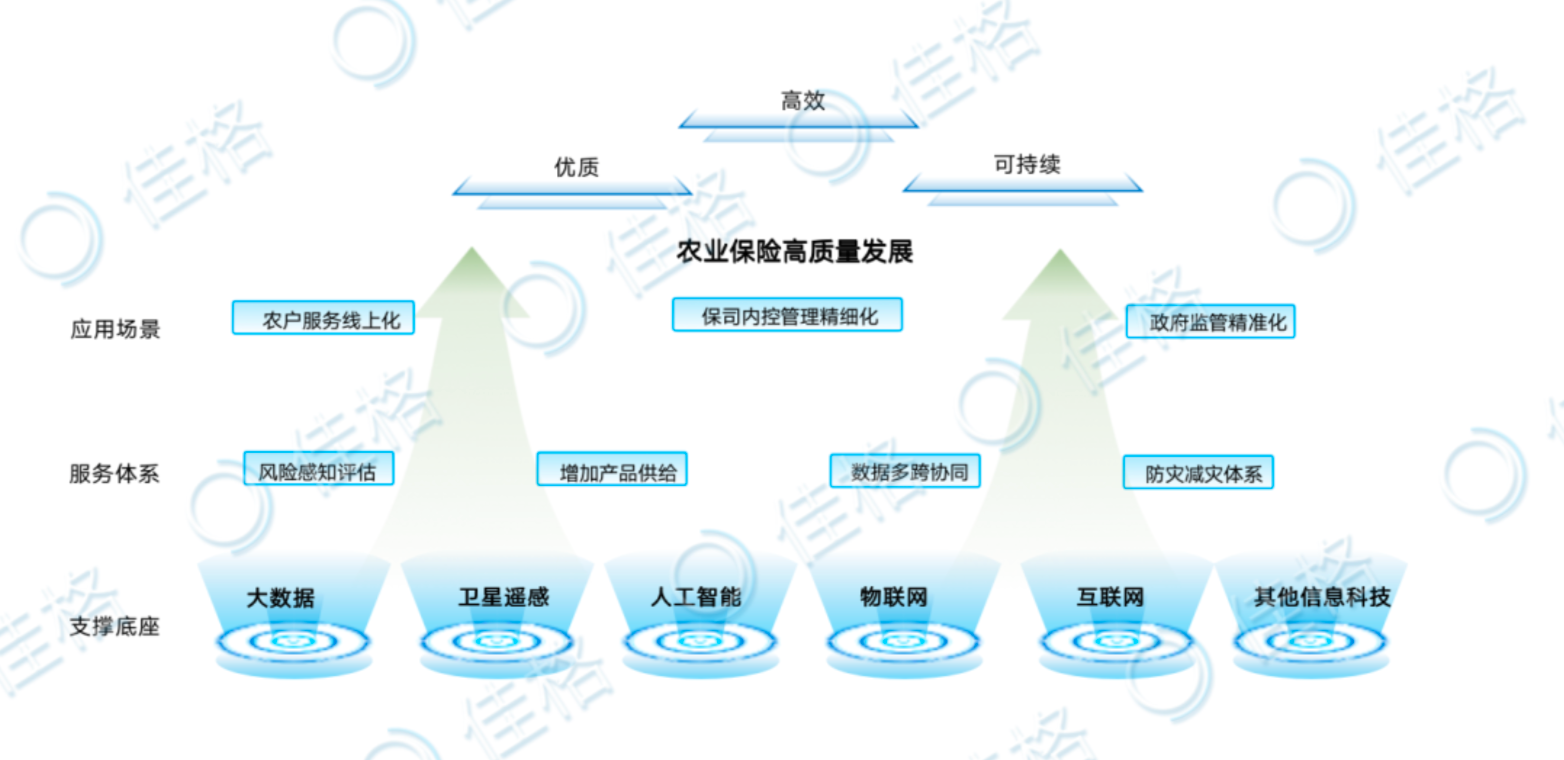 佳格天地與河北征信、秦皇島獨角獸達成戰略合作,協同推進農業金融數字化轉型 近期,佳格天地與河北省征信有限公...
佳格天地與河北征信、秦皇島獨角獸達成戰略合作,協同推進農業金融數字化轉型 近期,佳格天地與河北省征信有限公...
文章排行
圖片新聞
-
 國慶假期懷柔北部山區的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區的紅葉進入...
國慶假期懷柔北部山區的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區的紅葉進入... -
 重磅!四川省科創貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲...
重磅!四川省科創貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲... -
 252項“全程網辦”!川渝兩地企業登記檔案實現跨區域互查 8月30日,記者從省大數據中心獲悉...
252項“全程網辦”!川渝兩地企業登記檔案實現跨區域互查 8月30日,記者從省大數據中心獲悉... -
 2022年中國國際服務貿易交易會在京舉辦 四川參展企業數量創新高 8月31日至9月5日,主題為服務合作...
2022年中國國際服務貿易交易會在京舉辦 四川參展企業數量創新高 8月31日至9月5日,主題為服務合作...