百濟神州(688235.SH)發(fā)布半年報,研發(fā)布局持續(xù)賦能全球化創(chuàng)新
8月2日晚間,百濟神州(納斯達克代碼:BGNE;香港聯(lián)交所代碼:06160.HK;上交所代碼:688235.SH)公布2023年第二季度美股業(yè)績報告及A股半年度業(yè)績快報。
2023年上半年,得益于自主研發(fā)產(chǎn)品和授權產(chǎn)品的銷售增長,百濟神州營業(yè)收入較上年同期增加72.2%,達到72.51億元。產(chǎn)品收入實現(xiàn)66.96億元,同比增長82.2%。2023上半年,百濟神州的產(chǎn)品收入已接近去年全年八成。
 (資料圖片)
(資料圖片)
與此同時,百濟神州于7月18日舉辦了投資者研發(fā)日活動,圍繞公司深厚且廣泛的全球創(chuàng)新研發(fā)管線和平臺,分享了最新進展。目前,百濟神州在研管線涵蓋23個開發(fā)項目和超過60個臨床前項目,廣泛覆蓋血液瘤、實體瘤領域各高發(fā)瘤種。據(jù)介紹,百濟神州計劃在未來18個月,推動超過15款新分子進入臨床階段。
百濟神州聯(lián)合創(chuàng)始人、董事長兼首席執(zhí)行官歐雷強(John V. Oyler)表示:“我們在第二季度取得強勁的業(yè)績表現(xiàn),持續(xù)彰顯了公司全球商業(yè)化團隊的執(zhí)行力,以及百悅澤?和百澤安?這兩款基石藥物的成功。在近期的投資者研發(fā)日活動中,我們展示了公司在研發(fā)管線上強有力的布局。作為一家立足于科學的公司,百濟神州建立了業(yè)內規(guī)模最大、最高產(chǎn)的腫瘤研究團隊之一,我們的研發(fā)管線將持續(xù)推動公司短期與長期的發(fā)展,進而更好地踐行我們?yōu)槿蚋嗷颊咛峁﹦?chuàng)新性抗腫瘤藥物、改善治療選擇的使命。”
血液學布局領先,澤布替尼全球加速放量
百濟神州在血液腫瘤領域的布局中,百悅澤?(澤布替尼)正是其最具代表性的自研產(chǎn)品之一,以更優(yōu)的療效和安全性,成為新一代“同類最佳”BTK抑制劑,為患者和醫(yī)生提供全新治療選擇。
2023年上半年,百悅澤?實現(xiàn)全球銷售額36.12億元,美股財報顯示,同比增長139%。其中,在以美國為首的全球市場保持快速放量,報告期內,百悅澤?在美銷售額25.19億元,相較上年同期10.15億元,增長超過一倍。在國內,百悅澤?的表現(xiàn)亦可圈可點,上半年銷售額達6.69億元,去年同期4.55億元。
澤布替尼在海內外取得亮眼成績,既體現(xiàn)了百濟神州強大的全球商業(yè)化能力,更離不開產(chǎn)品本身的差異性和研發(fā)布局。據(jù)研發(fā)日活動介紹,澤布替尼作為一款強效的BTK抑制劑,已在所有適應癥中顯示出令人印象深刻的優(yōu)效性,包括在初治慢性淋巴細胞白血病(CLL)中效果優(yōu)于化療、兩項全球3期“頭對頭”研究優(yōu)于一代同類產(chǎn)品。
目前,澤布替尼在全球已獲批多項適應癥,覆蓋CLL、華氏巨球蛋白血癥(WM)、套細胞淋巴瘤(MCL)、邊緣區(qū)淋巴瘤(MZL),是獲批適應癥數(shù)量最多的BTK抑制劑。今年上半年,百濟神州在美國和歐盟遞交了澤布替尼聯(lián)合奧妥珠單抗治療濾泡性淋巴瘤(FL)的新適應癥上市許可申請。FDA預計將于2024年第一季度對該項申請做出決定,澤布替尼有望進一步拓寬其適應癥,在該領域中占據(jù)重要一席。
澤布替尼是百濟神州血液腫瘤管線內的“先頭力量”,實際上,百濟神州在這一領域的研發(fā)布局深厚,正在開發(fā)潛在“同類最佳”sonrotoclax(BCL2抑制劑)和BTK CDAC作為澤布替尼的補充,以進一步擴展至更多的惡性血液疾病領域。
在CLL這一領域,百濟神州三大血液管線產(chǎn)品互為聯(lián)用,有望覆蓋患者整個治療過程,也印證了公司在該疾病治療領域的領導地位。目前,sonrotoclax臨床試驗中已入組超過500例患者,I期試驗中單藥和聯(lián)合都有顯著治療效果,與澤布替尼聯(lián)合治療初治CLL達到100%的緩解率。另一款產(chǎn)品BTK CDAC也顯示出治療潛力,I期試驗中200mg單藥治療復發(fā)難治CLL患者可達89%緩解率,值得注意的是這些患者絕大部分既往已經(jīng)接受過BTK抑制劑治療,目前沒有有效治療選擇。
數(shù)據(jù)顯示,全球BTK、BCL2和BTK CDAC的市場規(guī)模將有望在2028年達到220億美元。憑借多款同類最佳潛力藥物,百濟神州將成為全球血液學市場強有力的競爭者,未來全球放量大有可為。
實體瘤產(chǎn)品組合廣泛,PD-1放量能力保持領先
在實體瘤領域,百濟神州核心產(chǎn)品百澤安?(替雷利珠單抗)在競爭最激烈的PD-1/PD-L1賽道取得亮眼的成績。2023年上半年,替雷利珠單抗在國內市場銷量再提速,達到了18.36億元,美股財報顯示,同比增長42.5%。
作為國內第7款的PD-1/PD-L1產(chǎn)品,替雷利珠單抗自上市以來屢獲突破,適應癥布局遙遙領先。截至2023年上半年,替雷利珠單抗獲NMPA批準11項適應癥,其中9項已獲批適應癥已被納入國家醫(yī)保目錄,是國內獲批適應癥最廣泛、納入醫(yī)保適應癥數(shù)量最多的PD-1產(chǎn)品。
在全球化進程方面,替雷利珠單抗已在全球多個市場遞交新藥上市申請,相關審評工作正在持續(xù)推進中。其中,在美國,F(xiàn)DA正在審評對替雷利珠單抗用于二線治療食管鱗癌(ESCC)的新藥上市許可申請,目前已于第二季度完成此項申請獲批前的生產(chǎn)基地現(xiàn)場核查。在歐盟,歐洲EMA正在審評二線ESCC的上市許可申請,EMA人用藥品委員會(CHMP)已發(fā)布其推薦替雷利珠單抗獲得此項適應癥上市許可的積極意見。
對于替雷利珠單抗的研發(fā),百濟神州在研發(fā)日活動上表示,替雷利珠單抗具有巨大潛力,將確定其作為多種腫瘤類型全球療法標準PD-1。據(jù)統(tǒng)計,已有超過75萬例患者接受了替雷利珠單抗的商業(yè)化治療,切實惠及廣泛患者。
以PD-1為中心,百濟神州已建立了泛腫瘤免疫療法管線產(chǎn)品,加速開發(fā)包括肺癌、上消化道、結直腸等重點實體瘤類型。目前,替雷利珠單抗正在與超過20個免疫療法和靶向分子聯(lián)用,包括TIGIT、LAG3、TIM3、OX40等,形成新一輪免疫療法產(chǎn)品。今年下半年,百濟神州將推進CCR8、DGKζ、PVRIG和CDK4抑制劑進入臨床,打造差異化“同類最佳”乃至“同類首創(chuàng)”的創(chuàng)新優(yōu)勢。
深耕研發(fā),加速規(guī)模化創(chuàng)新
除了鞏固自身在血液腫瘤和實體腫瘤領域的差異化地位,百濟神州也積極布局前沿創(chuàng)新,為未來儲備充足的發(fā)展動力。
事實上,百濟神州擁有超過60項臨床前研究項目,約半數(shù)具備“同類首創(chuàng)”的潛力,廣泛涵蓋小分子、CDAC、單抗、雙抗/三抗、ADC、細胞療法、mRNA等內部技術平臺和治療模式。
以肺癌領域為例,百濟神州擁有超過30個靶點和多樣化的治療模式,廣泛涵蓋各類肺癌患者。據(jù)介紹,公司7大研發(fā)重點涵蓋3款小分子(EGFR CDAC、泛KRAS抑制劑、MTA協(xié)同PRMT5抑制劑)、2款ADC(B7-H3 ADC、CEA ADC),以及2款雙特異性抗體(MUC1 x CD16A 雙抗、Claudin6 x CD3雙抗)。如EGFR突變、KRAS突變和MTAP缺失占肺癌患者數(shù)量超過一半以上,靶點開發(fā)已覆蓋核心治療領域。
鋪陳出如此龐大且差異化的創(chuàng)新靶點和管線,離不開百濟神州構建的內部自主研發(fā)能力。目前,百濟神州已打造了一支業(yè)內規(guī)模最大、約1,100名的專注于腫瘤學領域的研究團隊。自2024年起,這一支富有創(chuàng)新精神的團隊預計將每年推出10款差異化新分子實體。
此外,臨床開發(fā)方面,通過內部生產(chǎn)和“去CRO化”的開發(fā)模式,百濟神州顯著降低開發(fā)成本,加快從臨床前候選化合物到臨床概念驗證進程,時間縮短超過6個月。值得一提的是,百濟神州也是業(yè)內極少數(shù)能夠自主開展全球3期臨床試驗的創(chuàng)新藥企,臨床試驗已覆蓋全球48個市場。
重磅產(chǎn)品全球商業(yè)化迎來收獲期,后續(xù)管線蓄力長期發(fā)展,同時具備成熟的全產(chǎn)業(yè)價值鏈運營能力,百濟神州在十三年的歷程中,已確立了其在腫瘤藥物研發(fā)、商業(yè)化的領先地位。憑借其覆蓋藥物開發(fā)全流程的能力與平臺,公司將有望朝著全球市場大步邁進,開啟下一個創(chuàng)新浪潮。
關鍵詞:
-
 百濟神州(688235.SH)發(fā)布半年報,研發(fā)布局持續(xù)賦能全球化創(chuàng)新 8月2日晚間,百濟神州(納斯達克代碼:BGNE;香港聯(lián)交所代碼:06160 HK;
百濟神州(688235.SH)發(fā)布半年報,研發(fā)布局持續(xù)賦能全球化創(chuàng)新 8月2日晚間,百濟神州(納斯達克代碼:BGNE;香港聯(lián)交所代碼:06160 HK; -
 香雪制藥(300147.SZ)擬定增募資不超9.6億元 用于多個項目及補充流資 智通財經(jīng)APP訊,香雪制藥(300147)(300147 SZ)披露2023年度向特定對象發(fā)
香雪制藥(300147.SZ)擬定增募資不超9.6億元 用于多個項目及補充流資 智通財經(jīng)APP訊,香雪制藥(300147)(300147 SZ)披露2023年度向特定對象發(fā) -
 燦瑞科技(688061.SH)發(fā)布上半年業(yè)績,凈虧損834.34萬元,由盈轉虧 智通財經(jīng)APP訊,燦瑞科技(688061 SH)發(fā)布2023年半年度報告,該公司報告
燦瑞科技(688061.SH)發(fā)布上半年業(yè)績,凈虧損834.34萬元,由盈轉虧 智通財經(jīng)APP訊,燦瑞科技(688061 SH)發(fā)布2023年半年度報告,該公司報告 -
 景業(yè)智能(688290.SH)實控人控股比例被動稀釋達比例1.35% 智通財經(jīng)APP訊,景業(yè)智能(688290 SH)公告,公司以簡易程序向特定對象發(fā)
景業(yè)智能(688290.SH)實控人控股比例被動稀釋達比例1.35% 智通財經(jīng)APP訊,景業(yè)智能(688290 SH)公告,公司以簡易程序向特定對象發(fā) -
 凱旺科技(301182.SZ):在超導材料方面未取得實際成果,公司目前已經(jīng)調整了研究方向 格隆匯8月2日丨有投資者向凱旺科技(301182 SZ)提問,“公司旗下研究院
凱旺科技(301182.SZ):在超導材料方面未取得實際成果,公司目前已經(jīng)調整了研究方向 格隆匯8月2日丨有投資者向凱旺科技(301182 SZ)提問,“公司旗下研究院 -
 中國新消費集團(08275.HK)供股獲認購約84.5% 格隆匯8月2日丨中國新消費集團(08275 HK)公布,于2023年7月25日下午四
中國新消費集團(08275.HK)供股獲認購約84.5% 格隆匯8月2日丨中國新消費集團(08275 HK)公布,于2023年7月25日下午四
-
 百濟神州(688235.SH)發(fā)布半年報,研發(fā)布局持續(xù)賦能全球化創(chuàng)新 8月2日晚間,百濟神州(納斯達克代碼:BGNE;香港聯(lián)交所代碼:06160 HK;
百濟神州(688235.SH)發(fā)布半年報,研發(fā)布局持續(xù)賦能全球化創(chuàng)新 8月2日晚間,百濟神州(納斯達克代碼:BGNE;香港聯(lián)交所代碼:06160 HK; -
 香雪制藥(300147.SZ)擬定增募資不超9.6億元 用于多個項目及補充流資 智通財經(jīng)APP訊,香雪制藥(300147)(300147 SZ)披露2023年度向特定對象發(fā)
香雪制藥(300147.SZ)擬定增募資不超9.6億元 用于多個項目及補充流資 智通財經(jīng)APP訊,香雪制藥(300147)(300147 SZ)披露2023年度向特定對象發(fā) -
 燦瑞科技(688061.SH)發(fā)布上半年業(yè)績,凈虧損834.34萬元,由盈轉虧 智通財經(jīng)APP訊,燦瑞科技(688061 SH)發(fā)布2023年半年度報告,該公司報告
燦瑞科技(688061.SH)發(fā)布上半年業(yè)績,凈虧損834.34萬元,由盈轉虧 智通財經(jīng)APP訊,燦瑞科技(688061 SH)發(fā)布2023年半年度報告,該公司報告 -
 景業(yè)智能(688290.SH)實控人控股比例被動稀釋達比例1.35% 智通財經(jīng)APP訊,景業(yè)智能(688290 SH)公告,公司以簡易程序向特定對象發(fā)
景業(yè)智能(688290.SH)實控人控股比例被動稀釋達比例1.35% 智通財經(jīng)APP訊,景業(yè)智能(688290 SH)公告,公司以簡易程序向特定對象發(fā) -
 房山這個村4000多村民無一受傷,村支書正組織村民恢復家園 北京日報客戶端|記者陳強安旭東房山區(qū)青龍湖鎮(zhèn)政府正北5公里的淺山區(qū),
房山這個村4000多村民無一受傷,村支書正組織村民恢復家園 北京日報客戶端|記者陳強安旭東房山區(qū)青龍湖鎮(zhèn)政府正北5公里的淺山區(qū), -
 龍將怎么搭配士氣石 龍將呂布配備的是什么石頭?將向魔術師游龍介紹高檔攻略。魔術師游龍會
龍將怎么搭配士氣石 龍將呂布配備的是什么石頭?將向魔術師游龍介紹高檔攻略。魔術師游龍會 -
 大阪地區(qū)語言學校精選 ECC國際外語專門學校-日本語科 ECC國際外語專門學校是ECC教育集團下屬的專門學校。該集團擁有200家以
大阪地區(qū)語言學校精選 ECC國際外語專門學校-日本語科 ECC國際外語專門學校是ECC教育集團下屬的專門學校。該集團擁有200家以 -
 閔行1幅商品住宅用地成交,緊鄰在建地標型商業(yè)文化綜合體 閔行1幅商品住宅用地成交,緊鄰在建地標型商業(yè)文化綜合體,閔行,濱江,梅
閔行1幅商品住宅用地成交,緊鄰在建地標型商業(yè)文化綜合體 閔行1幅商品住宅用地成交,緊鄰在建地標型商業(yè)文化綜合體,閔行,濱江,梅 -
 凱旺科技(301182.SZ):在超導材料方面未取得實際成果,公司目前已經(jīng)調整了研究方向 格隆匯8月2日丨有投資者向凱旺科技(301182 SZ)提問,“公司旗下研究院
凱旺科技(301182.SZ):在超導材料方面未取得實際成果,公司目前已經(jīng)調整了研究方向 格隆匯8月2日丨有投資者向凱旺科技(301182 SZ)提問,“公司旗下研究院 -
 中國新消費集團(08275.HK)供股獲認購約84.5% 格隆匯8月2日丨中國新消費集團(08275 HK)公布,于2023年7月25日下午四
中國新消費集團(08275.HK)供股獲認購約84.5% 格隆匯8月2日丨中國新消費集團(08275 HK)公布,于2023年7月25日下午四 -
 福萊特(601865.SH):擬使用不超20億元的閑置募集資金進行現(xiàn)金管理 格隆匯8月2日丨福萊特(601865)(601865 SH)公布,公司擬使用總額不超過
福萊特(601865.SH):擬使用不超20億元的閑置募集資金進行現(xiàn)金管理 格隆匯8月2日丨福萊特(601865)(601865 SH)公布,公司擬使用總額不超過 -
 天元醫(yī)療(00557.HK)擬8月30日舉行董事會會議批準中期業(yè)績 格隆匯8月2日丨天元醫(yī)療(00557 HK)公告,公司董事會將于2023年8月30日(
天元醫(yī)療(00557.HK)擬8月30日舉行董事會會議批準中期業(yè)績 格隆匯8月2日丨天元醫(yī)療(00557 HK)公告,公司董事會將于2023年8月30日( -
 梅西代言貴州白酒?客服回應:是真的!背后老板是化肥龍頭 加冕球王之后,梅西今年的中國行既是球迷的狂歡,也是一場商業(yè)盛宴。梅
梅西代言貴州白酒?客服回應:是真的!背后老板是化肥龍頭 加冕球王之后,梅西今年的中國行既是球迷的狂歡,也是一場商業(yè)盛宴。梅 -
 永輝超市:不存在“京東洽談全資收購永輝”相關事宜 【永輝超市:不存在“京東洽談全資收購永輝”相關事宜】永輝超市8月2日
永輝超市:不存在“京東洽談全資收購永輝”相關事宜 【永輝超市:不存在“京東洽談全資收購永輝”相關事宜】永輝超市8月2日 -
 焦煤龍虎榜 | 2309合約今日減倉上行 前20席位凈持倉較長時間內處于凈空態(tài)勢 焦煤2309合約今日減倉上行,多空持倉排名前20席中,多空雙方均呈退場態(tài)
焦煤龍虎榜 | 2309合約今日減倉上行 前20席位凈持倉較長時間內處于凈空態(tài)勢 焦煤2309合約今日減倉上行,多空持倉排名前20席中,多空雙方均呈退場態(tài) -
 電影《封神第一部》總票房破13億 每經(jīng)AI快訊,8月2日,據(jù)貓眼專業(yè)版數(shù)據(jù),電影《封神第一部》總票房破13
電影《封神第一部》總票房破13億 每經(jīng)AI快訊,8月2日,據(jù)貓眼專業(yè)版數(shù)據(jù),電影《封神第一部》總票房破13 -
 GTA5V3破解補丁亂碼解決辦法 破解補丁停止運行的解決 gta5破解版補丁怎么用 GTA5V3破解補丁亂碼解決辦法GTA5V3破解補丁停止運行解決辦法俠盜獵車手
GTA5V3破解補丁亂碼解決辦法 破解補丁停止運行的解決 gta5破解版補丁怎么用 GTA5V3破解補丁亂碼解決辦法GTA5V3破解補丁停止運行解決辦法俠盜獵車手 -
 際華集團(601718.SH)2022年度擬每股派0.03元 8月9日除權除息 智通財經(jīng)APP訊,際華集團(601718)(601718 SH)公告,公司2022年年度擬每
際華集團(601718.SH)2022年度擬每股派0.03元 8月9日除權除息 智通財經(jīng)APP訊,際華集團(601718)(601718 SH)公告,公司2022年年度擬每 -
 民富國際(08511)附屬完成收購福圓文化20%股權 智通財經(jīng)APP訊,民富國際(08511)發(fā)布公告,有關黃岡市福圓文化發(fā)展有限
民富國際(08511)附屬完成收購福圓文化20%股權 智通財經(jīng)APP訊,民富國際(08511)發(fā)布公告,有關黃岡市福圓文化發(fā)展有限 -
 御銀股份(002177.SZ):收到御聯(lián)軟件分紅款3900萬元 格隆匯8月2日丨御銀股份(002177)(002177 SZ)公布,御聯(lián)軟件依據(jù)廣州久
御銀股份(002177.SZ):收到御聯(lián)軟件分紅款3900萬元 格隆匯8月2日丨御銀股份(002177)(002177 SZ)公布,御聯(lián)軟件依據(jù)廣州久 -
 大行評級丨高盛:下調信義能源目標價至3.9港元 續(xù)列“確信買入”名單 格隆匯8月2日丨高盛發(fā)表研報指,信義能源上半年業(yè)績勝預期,純利達到5
大行評級丨高盛:下調信義能源目標價至3.9港元 續(xù)列“確信買入”名單 格隆匯8月2日丨高盛發(fā)表研報指,信義能源上半年業(yè)績勝預期,純利達到5 -
 CHINAPROPERTIES(01838.HK)上市地位將予以取消 格隆匯8月2日丨CHINAPROPERTIES(01838 HK)公布,由2023年8月4日上午9時
CHINAPROPERTIES(01838.HK)上市地位將予以取消 格隆匯8月2日丨CHINAPROPERTIES(01838 HK)公布,由2023年8月4日上午9時 -
 九號公司焦慮的背后是什么 作者l大釗九號公司越來越像是一家兩輪電動車企業(yè)了。兩個月前,九號公
九號公司焦慮的背后是什么 作者l大釗九號公司越來越像是一家兩輪電動車企業(yè)了。兩個月前,九號公 -
 探訪蘇家坨鎮(zhèn)安置點!居民:“心里特別踏實” 7月29日以來
北京出現(xiàn)極端強降雨天氣
在此輪強降雨中
為保障居民群眾的
探訪蘇家坨鎮(zhèn)安置點!居民:“心里特別踏實” 7月29日以來
北京出現(xiàn)極端強降雨天氣
在此輪強降雨中
為保障居民群眾的 -
 興森科技:子公司廣州興森擬增資16.05億元并引入戰(zhàn)投 興森科技8月2日晚間公告,為推進FCBGA封裝基板項目的建設進程,公司擬
興森科技:子公司廣州興森擬增資16.05億元并引入戰(zhàn)投 興森科技8月2日晚間公告,為推進FCBGA封裝基板項目的建設進程,公司擬 -
 錦州這個海水浴場水質為良,較適宜游泳 2023年部分沿海城市海水浴場水質概況(第15期)2023年7月21日~7月24日
錦州這個海水浴場水質為良,較適宜游泳 2023年部分沿海城市海水浴場水質概況(第15期)2023年7月21日~7月24日 -
 首屆嶺南文化灣區(qū)論壇聚焦嶺南文化傳承創(chuàng)新 中新網(wǎng)廣州8月2日電(許青青黃蓉芳張成)嶺南文化源遠流長,以“傳承嶺南
首屆嶺南文化灣區(qū)論壇聚焦嶺南文化傳承創(chuàng)新 中新網(wǎng)廣州8月2日電(許青青黃蓉芳張成)嶺南文化源遠流長,以“傳承嶺南 -
 海底撈可以加盟嗎?_海底撈加盟費及加盟條件 1、停止加盟聲明時間:2010-3-8聲明近期我公司發(fā)現(xiàn)有網(wǎng)站以“海底撈”
海底撈可以加盟嗎?_海底撈加盟費及加盟條件 1、停止加盟聲明時間:2010-3-8聲明近期我公司發(fā)現(xiàn)有網(wǎng)站以“海底撈” -
 水晶光電(002273.SZ):終止分拆所屬子公司夜視麗至創(chuàng)業(yè)板上市 格隆匯8月2日丨水晶光電(002273)(002273 SZ)公布,公司于2023年8月2日
水晶光電(002273.SZ):終止分拆所屬子公司夜視麗至創(chuàng)業(yè)板上市 格隆匯8月2日丨水晶光電(002273)(002273 SZ)公布,公司于2023年8月2日 -
 慧智微(688512.SH):公司GaAs晶圓的主要供應商主要為穩(wěn)懋 格隆匯8月2日丨慧智微(688512 SH)8月2日在互動平臺回復稱,公司GaAs晶
慧智微(688512.SH):公司GaAs晶圓的主要供應商主要為穩(wěn)懋 格隆匯8月2日丨慧智微(688512 SH)8月2日在互動平臺回復稱,公司GaAs晶
熱門資訊
-
 行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監(jiān)管、公安、市...
行政拘留!以虛假證明、惡意投訴騙取關懷,招行信用卡堅決拒絕 近期,全國多地金融監(jiān)管、公安、市... -
 58汽車聯(lián)合J.D. Power發(fā)布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現(xiàn) 保值率是汽車品牌溢價與產(chǎn)品力的重...
58汽車聯(lián)合J.D. Power發(fā)布《中國汽車保值率風云榜》:中國品牌多點開花黑馬頻現(xiàn) 保值率是汽車品牌溢價與產(chǎn)品力的重... -
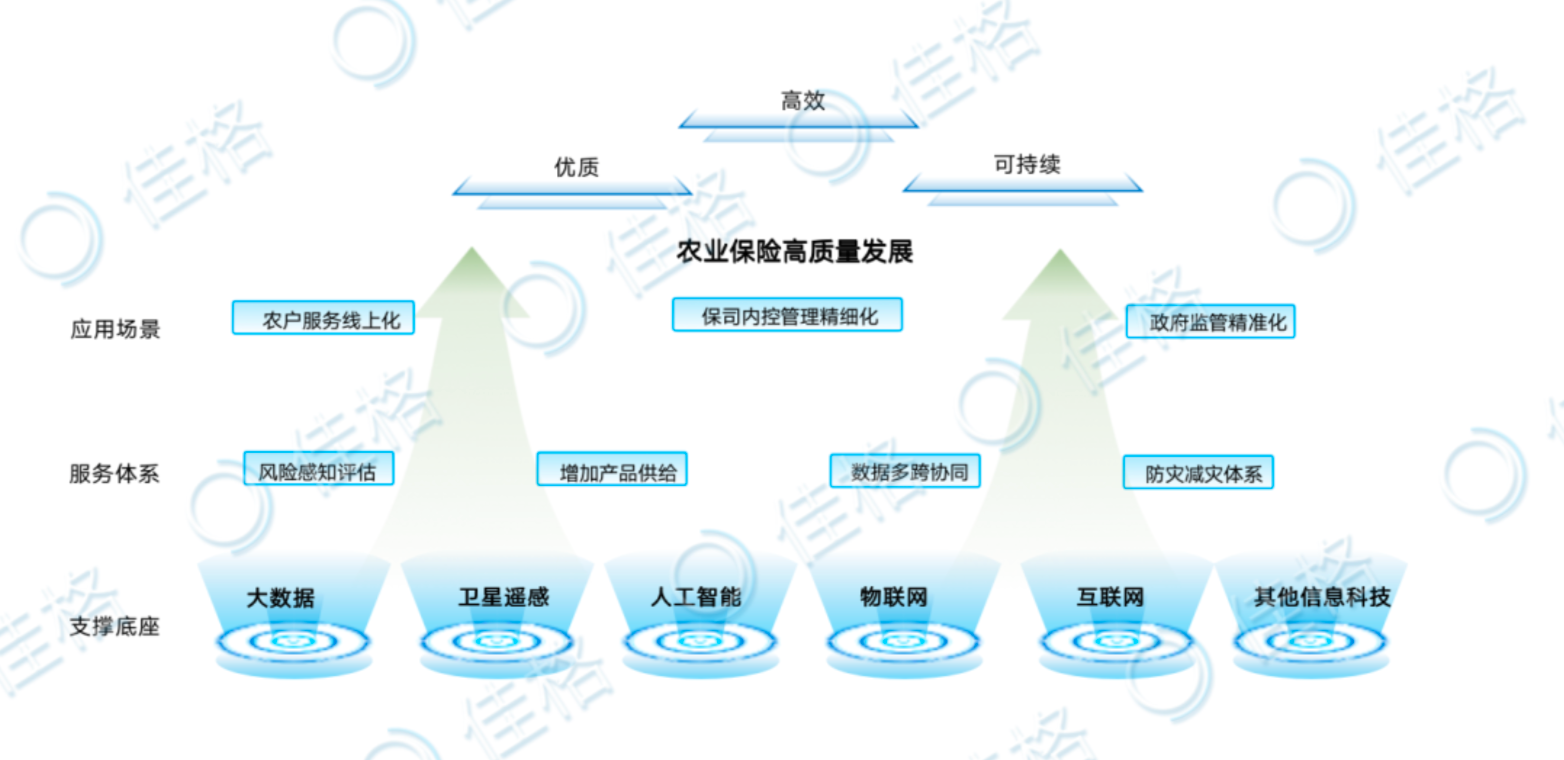 佳格天地與河北征信、秦皇島獨角獸達成戰(zhàn)略合作,協(xié)同推進農(nóng)業(yè)金融數(shù)字化轉型 近期,佳格天地與河北省征信有限公...
佳格天地與河北征信、秦皇島獨角獸達成戰(zhàn)略合作,協(xié)同推進農(nóng)業(yè)金融數(shù)字化轉型 近期,佳格天地與河北省征信有限公... -
 大樹云“彩云郵差”:關愛山區(qū)女孩健康成長的使者 2023年,大樹云集團開展了一系列幫...
大樹云“彩云郵差”:關愛山區(qū)女孩健康成長的使者 2023年,大樹云集團開展了一系列幫...
文章排行
圖片新聞
-
 國慶假期懷柔北部山區(qū)的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區(qū)的紅葉進入...
國慶假期懷柔北部山區(qū)的紅葉進入最佳觀賞期 吸引游客前來賞秋景 國慶假期,懷柔北部山區(qū)的紅葉進入... -
 重磅!四川省科創(chuàng)貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲...
重磅!四川省科創(chuàng)貸款較年初新增620.35億元 同比增長21.22% 記者日前從中國人民銀行成都分行獲... -
 252項“全程網(wǎng)辦”!川渝兩地企業(yè)登記檔案實現(xiàn)跨區(qū)域互查 8月30日,記者從省大數(shù)據(jù)中心獲悉...
252項“全程網(wǎng)辦”!川渝兩地企業(yè)登記檔案實現(xiàn)跨區(qū)域互查 8月30日,記者從省大數(shù)據(jù)中心獲悉... -
 2022年中國國際服務貿易交易會在京舉辦 四川參展企業(yè)數(shù)量創(chuàng)新高 8月31日至9月5日,主題為服務合作...
2022年中國國際服務貿易交易會在京舉辦 四川參展企業(yè)數(shù)量創(chuàng)新高 8月31日至9月5日,主題為服務合作...